Síndrome hiperglucémico hiperosmolar
(Reseña publicada en la WEB de la SEPEAP el 7 de Abril de 2010)
Las primeras descripciones de coma diabético datan
de 1886 y se deben a Bradshawe, otros autores coetáneos describen
diferentes formas de presentación del coma diabético, que incluye
cetonemia intensa en unos casos y ausencia de la misma en otros. Se debe
a Schwartz en 1957, la primera descripción del coma hiperosmolar no
cetósico o síndrome hiperglucémico hiperosmolar (SHH) como también se le
conoce, observándose que la presentación de este síndrome es habitual en
pacientes con diabetes tipo 2. Los criterios diagnósticos propuestos
para el diagnóstico de SHH son glucemia > 600 mg/dl, pCO2 > 15 mmHg,
ausencia o mínima cetonuria con ausencia de cetonemia, osmolaridad en
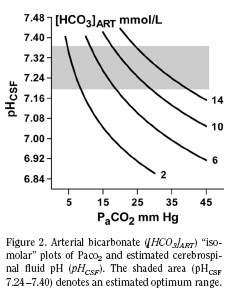
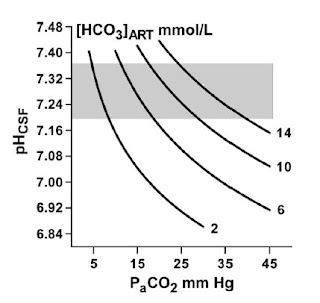
suero > 320 mOsm/l y presencia de estupor o coma. La acidosis, con
disminución compensatoria del pCO2, puede estar presente en ausencia de
cetosis, como resultado de la deshidratación y acidosis láctica. El
síndrome hiperglucémico hiperosmolar es infrecuente en edad pediátrica,
la primera descripción de SHH en niños se realizó en 1966, en 2008
existen 65 casos reportados. En A. L. Rosenbloom.
Hyperglycemic hyperosmolar state: an emerging
pediatric problem. J Pediatr 156 (2):180-184, 2010; se
realiza una revisión del tema de recomendada lectura.
Fisiopatología. Al igual que ocurre con la
cetocidosis diabética, el SHH se origina cuando existe un defecto de
insulina, con hiperglucemia como efecto de las hormonas de
contraregulación: glucagón, cortisol, catecolaminas y hormona del
cfrecimiento, en respuesta a una situación de estrés y/o inflamatoria.
Las hormonas contrareguladores estimulan la producción de glucosa a
nivel renal y hepático, reduciéndose la utilización de glucosa en los
tejidos periféricos dependientes de insulina (hígado, músculo, tejido
adiposo de la que resulta liberación de ácidos grasos libres en tejido
adiposo (lipolisis), la oxidación de los ácidos grasos a nivel hepático
origina la producción de cetogénesis en mayor o menor proporción. En
estas situaciones la insulina puede ser insuficiente para facilitar la
utilización de la misma en los tejidos insulindependientes, aunque es
suficente para la prevención de la lipolisis y cetogénesis.
El SHH generalmente ocurre tras una prolongada
poliuria y polidispsia que conducen a una situación de deshidratación,
se estima que la pérdida de líquidos en el SHH puede ser hasta dos
veces mayor que la originada por una cetoacidosis diabética. La mayor
duración de la situación de deshidratación justifica que las pérdidas de
electrolitos sean también mayores que las observadas en la cetoacidosis
diabética.
Epidemiología. La mayoría de los
casos pediátricos descritos se asocian a obesidad, diabetes tipo 2 y
alteraciones relacionadas con resistencia periférica a la insulina como
la acantosis nigricans.
Manifestaciones clínicas. El dolor
abdominal y los vómitos son mucho menos frecuentes en los pacientes
adultos con síndrome hiperglucémico hiperosomolar que en la cetoacidosis
diabética; no obstante en los pacientes pediátricos el dolor abdominal y
los vómitos pueden estar presentes hasta en el 50% de los casos,
asociados con los síntomas típicos de diabetes (poliuria y polidipsia).
La disnea, confusión, letargia son también frecuentes. Los síntomas de
deshidratación en ocasiones son difíciles de identificar en los
pacientes obesos, retrasándose el inicio de la fluidoterapia.
Tratamiento. Los tratamientos de
reposición hídrica muy agresivos, frecuentemente se asocian con
complicaciones derivados de los cambios osmolares intravasculares
bruscos. Se ha descrito un aumento de mortalidad en los sujetos en
situación de shock que reciben < 40 ml/Kg en las primeras 6 horas
de tratamiento. Debe monitorizarse el estado mental, función renal,
signos vitales, electrolitos, lipasa, creatininkinasa, glucosa y
osmolaridad. La existencia de hipernatremia, hipokaliemia, rabdomiolisis,
pancreatitis o trombosis son signos de mal pronóstico. La diálisis debe
considerarse precozmente ante la presencia de rabdomiolisis y fallo
renal. La fluidoterapia puede iniciarse con suero salino fisológico
(0.9%) que puede resultar hipotónico para estos pacientes; la mayor
diferencia en relación al protocolo de manejo de la cetoacidosis
diabética estriba en la recomendación de reponer las pérdidas urinarias
con suero salino al 0.45%. Al igual que en la cetoacidosis diabética se
requiere la administración de insulina en perfusión a un ritmo de 0.1 U/Kg/hora.
Dr. José Uberos Fernández

Comentarios
Publicar un comentario